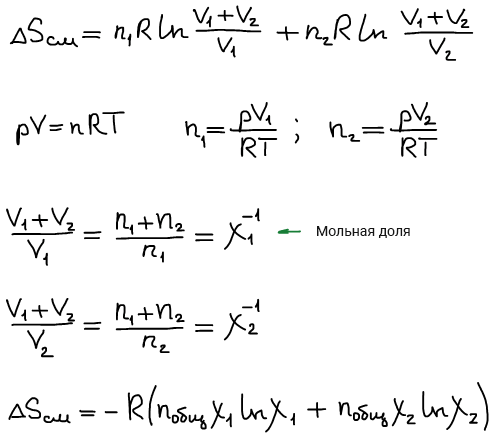Как найти энтропию газа
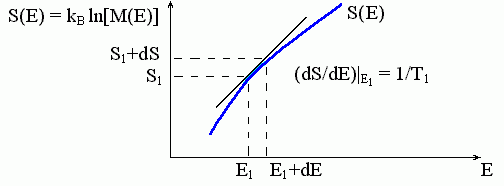
Изменение энтропии
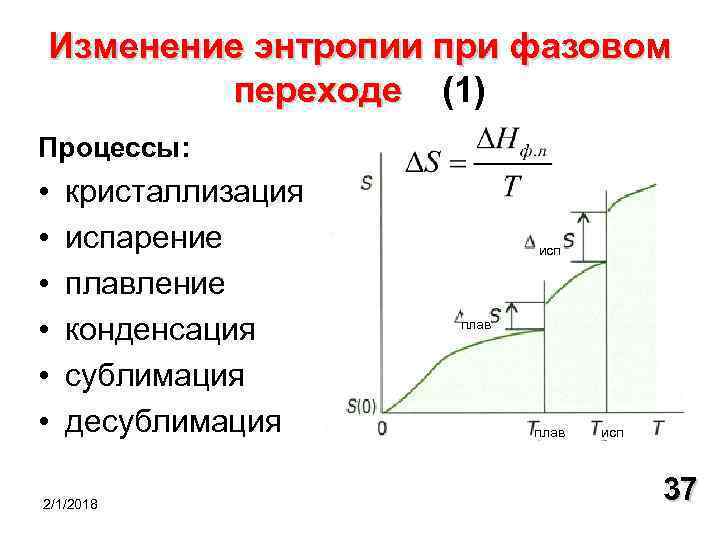
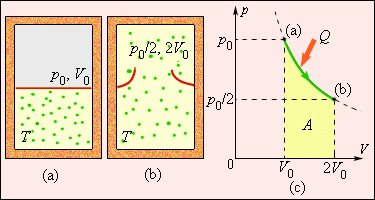
Рассмотрим жесткий сосуд, имеющий объем V и разделенный перегородкой на две части рис. Одну часть сосуда с объемом V 1 занимает газ при температуре Т ОС , равной температуре окружающей среды, в другой части сосуда — абсолютный вакуум. Поскольку газ и окружающая среда имеют одинаковые температуры, такая термодинамическая система находится в равновесном состоянии. Если убрать перегородку рис. Это типичный необратимый процесс, сопровождающийся увеличением энтропии системы и потерей возможной работы эксергии.







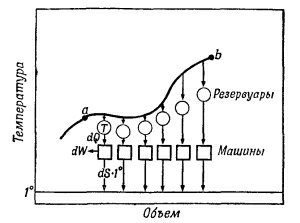
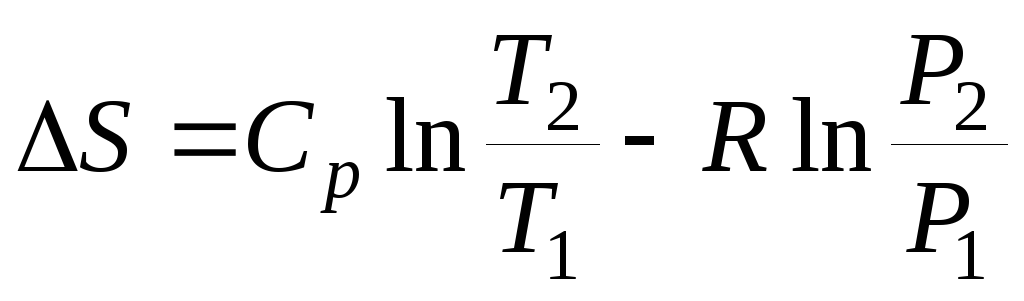

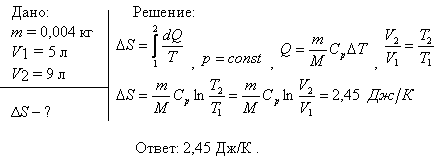
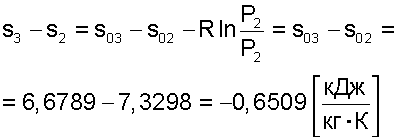

Таким образом, энтропия моля идеального газа является функцией Т и р так как молярный объем зависит от Т и р. Выражение 21 применимо лишь для чистого идеального газа, так как для смесей газов, даже при отсутствии между ними химических реакций, энтропия смеси будет возрастать за счет необратимых процессов диффузии, приводящей к распределению компонентов по всему объему газовой смеси. Рассмотрим процесс самопроизвольного смешения двух газов. Пусть в двух частях объема, разделенного перегородкой r рис.



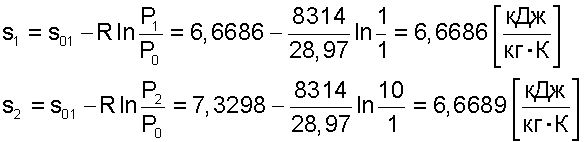




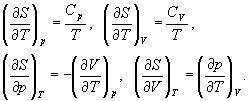
Приведите различные формулировки и математические выражения второго закона начала термодинамики в дифференциальной и интегральной формах. Приведите различные формулировки и математические выражения третьего закона термодинамики. Напишите математическое соотношение между изменением энтропии системы и переданной теплотой в случаях бесконечно малого и конечного изменения величин. Система переходит из состояния 1 в состояние 2 двумя путями: обратимым поглощает теплоту Q обр и необратимым поглощает теплоту Q необр. Каково соотношение между Q обр и Q необр?
.jpg/300px-Nicaragua_1971_Mi_1620_stamp_and_back_(The_Ten_Mathematical_Equations_that_Changed_the_Face_of_the_Earth._Boltzman's_equation_-_movement_of_gases).jpg)